Research
電気、化学、太陽エネルギーなどの変換・貯蔵・利用に関わる新規な「物質」、「デバイス」、「システム」について、また、次世代工業プロセスの開発を目指して、電気化学、物理化学、フッ素化学を基盤にした以下のような研究を行っています。
- 新規な溶融塩電解質の物性測定及び実用化に向けての検討
- 中低温イオン液体(溶融塩)のナトリウム二次電池電解質への応用
- 中低温イオン液体(溶融塩)のリチウム二次電池電解質への応用
- フルオロハイドロジェネートイオン液体の合成と構造解析
- 新規フッ素系イオン液体の合成と性質
- 新規イオン導電性中間相(柔粘性結晶と液晶)の開発と構造解析
- フッ素系化合物の結晶構造解析
新規な溶融塩電解質の物性測定及び実用化に向けての検討
種々の電池や電解工業を考える上で重要な要素の1つに電解質があります。より優れた性質を持つ電解質を用いることにより、電池においては安全性、耐久性、エネルギー密度の向上が、電解工業においては製品の品質やエネルギー効率の向上、環境負荷の低減が期待できます。近年、優れた特性が期待できる電解質として溶融塩が注目されています。一般に溶融塩はLiClやCaCO3等の塩が溶融したものを指し、室温では固体のもの多いですが、特に注目されているのは室温でも液体である室温溶融塩(イオン液体とも呼称されます)です。一般に溶融塩は水溶液などと比べて広い液相温度領域(これは高い熱的安定性を持つことを示唆します)、と広い電気化学窓(これは高い電気化学的安定性を持つことを示唆します)を持ち、電解質として優れた性質を有しています。また、蒸気圧が極めて低く不燃性であるため、発火等の危険性は低いことも溶融塩の特徴の一つです。このような特性から溶融塩は様々な分野で研究が行われており、一部実用化がなされています。
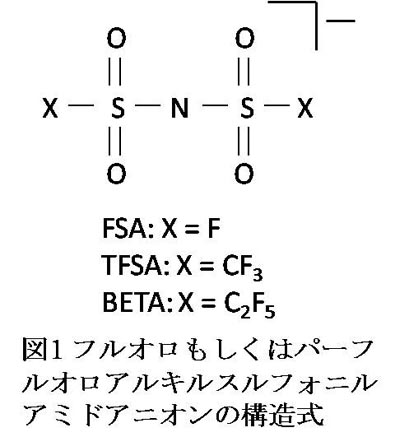
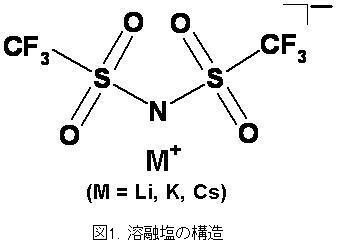
このような背景のもと、本研究グループでは図1に示すような構造を持つ3種類のフルオロもしくはパーフルオロアルキルスルフォニルアミドアニオン(それぞれFSA-、TFSA-、BETA-と呼称します)とアルカリ金属カチオン(略称M = Li, Na, K, Rb, Csとします)からなる塩(以降MTFSA、MBETA、MFSAと呼称します)に着目しました。具体的な実験内容としては、これらの塩を合成及び、融点、熱分解温度、粘性率、電気伝導率、電気化学窓等の物理化学的性質の測定、それらのデータを踏まえた電解質としての性能評価を行っています。
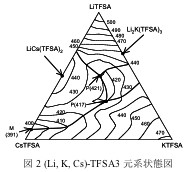
これまでの研究成果として、MTFSAとMFSAの単塩及び混合塩について上記の物性測定は完了しています。データの一例として図2に(Li, K, Cs)-TFSA三元系の相平衡状態図を示します。これらの溶融塩はリチウム金属二次電池及びナトリウム金属二次電池の電解質に有望であると分かりました。既存のリチウム二次電池は、揮発性かつ可燃性の有機溶媒を用いているため、特に電気自動車や電力貯蔵用を目的とした大型化の際に安全性の確保が課題となっています。また既存のナトリウム二次電池は、電解質としてNa+イオン導伝性セラミクスであるβ”-アルミナを用いているため、300℃という高温運転が必要であり、温度変化により電解質が割れやすいという課題があります。これらの課題はいずれも不揮発性、不燃性、液体でかつ広い使用温度域(60-300℃)というMTFSA混合塩やMFSA混合塩の使用により解決することができます。
中低温イオン液体(溶融塩)のナトリウム二次電池電解質への応用
当研究室では、リチウム二次電池に加えてナトリウム二次電池の研究も行っています。
リチウムはその標準酸化還元電位が最も低い金属の一つで、原子番号も小さいのでエネルギー密度が非常に大きい電池を組むことができます。しかし、資源の偏在性などの理由から、将来も同じ価格で充分な供給できるかどうか不透明です。
現在リチウム二次電池を電気自動車などの大型用途に応用しようとする研究が活発ですが、本格的な大量普及が始まるとリチウムの需要が高まり、値段が急騰したり、供給が不安定になったりする可能性があります。一方、ナトリウムは、塩化ナトリウムに代表されるように非常に身近な元素であり、存在量も豊富です[1]。標準酸化還元電位は、リチウムほどではありませんが、十分低く[1]、原子番号もアルカリ金属の中ではリチウムに次いで小さいため、比較的エネルギー密度の大きな電池を組むことが出来ます。すなわち、高性能の電池を低価格かつ大量に製造することが可能だと考えられます。
現在、ナトリウム二次電池として有名なものがナトリウム-硫黄(Na/S)電池、通称NAS電池です[2]。これはすでに電力貯蔵用として一部実用化されていますが、この電池は電解質として固体セラミックスを使っており、イオン導電性を上げるために作動温度が300℃程度と高いことが課題の一つです。特に昇温・降温サイクルに対して機械的強度が弱いため、常に加熱しておく必要があります。一方、リチウム系二次電池と同じように常温で作動するナトリウム二次電池の研究も近年行われていますが、ほとんどの場合、電解質に可燃性や揮発性を有する有機溶媒が用いられているため、大型化した際の安全性に問題があります。
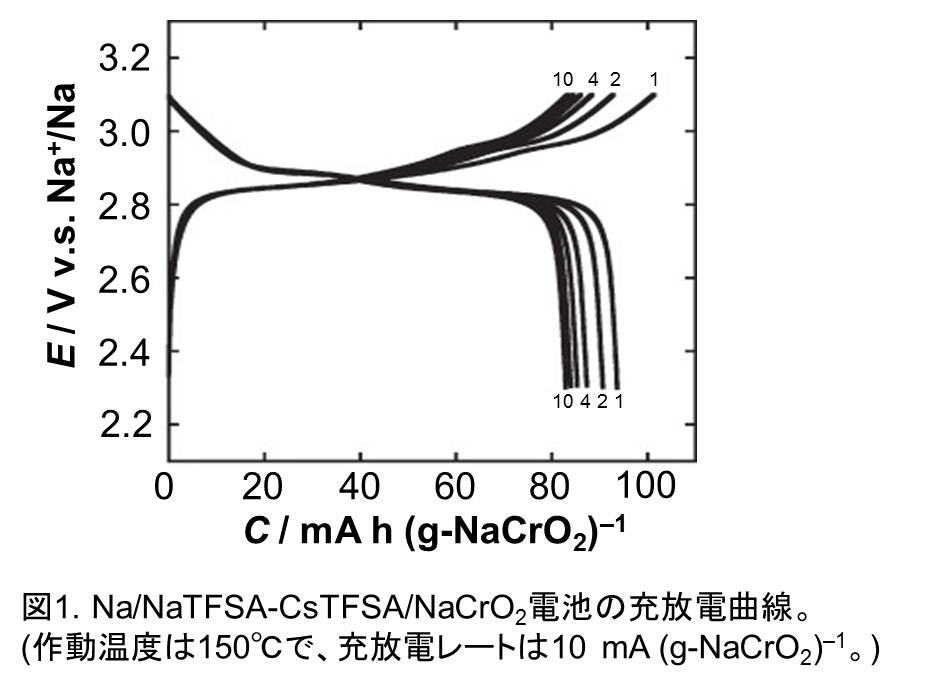
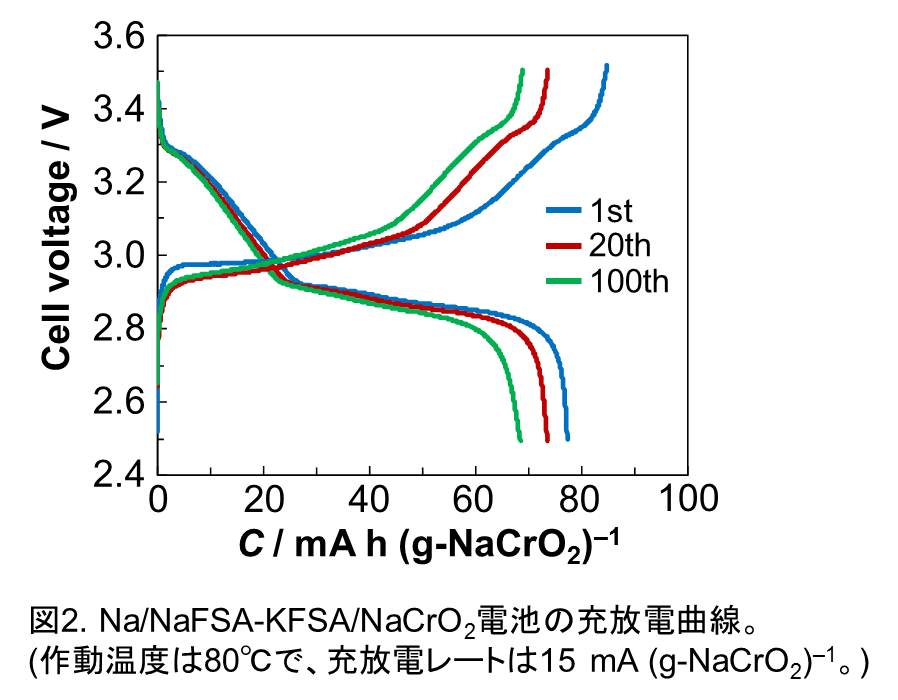
そこで、当研究室はNAS電池より低温で使用可能、かつ難燃性・難揮発性を有する安全性の高い液体電解質として、NaTFSA-CsTFSA二元系溶融塩[3]、及びNaFSA-KFSA二元系イオン液体[4]を開発しました。NaTFSA-CsTFSA二元系溶融塩は、組成を調整することでおよそ117℃において融解します。実際の作動温度は150℃程度となりますが、図1のようにこの溶融塩を電解質に用いたNa/NaCrO2電池が良好なサイクル特性を示すことが分かっています[5]。一方、NaFSA-KFSA二元系イオン液体はTFSA系よりも低温の61℃で融解することから、より低温での作動が期待されていましたが、実際に80℃においてNa/NaCrO2電池が安定したサイクル特性を示すことが分かり(図2)、100℃未満という比較的低温領域での作動を実現しました[6]。現在共同研究を行っている住友電気工業で組電池が製作され、実用化をめざした実証試験が行われています(図3)[7]。

参考文献:
[1] 日本化学会 編, 化学便覧 基礎編 改訂5版, 丸善 (2004).
[2] J.L. Sudworth, J. Power Sources, 11 (1984) 143.
[3] R. Hagiwara, K. Tamaki, K. Kubota, T. Goto, T. Nohira, J. Chem. Eng. Data, 53 (2008) 355.
[4] K. Kubota, T. Nohira, R. Hagiwara, J. Chem. Eng. Data, 55 (2010) 3142.
[5] T. Nohira, T. Ishibashi, R. Hagiwara, J. Power Sources, (2012) in press, doi:10.1016/j.jpowsour.2011.11.086.
[6] A. Fukunaga, T. Nohira, R. Hagiwara, S. Sakai, K. Nitta, and S. Inazawa, In The 62nd Annual Meeting of the International Society of Electrochemistry, Abs. Niigata, Japan (2011).
[7] 住友電気工業ホームページ http://www.sei.co.jp/news/press/11/prs894_s.html
中低温イオン液体(溶融塩)のリチウム二次電池電解質への応用
リチウム二次電池は作動電圧やエネルギー密度が高いため、携帯電話など、主にモバイル機器のバッテリーとして広く用いられていますが、電解液の有機溶媒が燃えやすいため、危険性が指摘されています。特に、電気自動車のバッテリーなど大型用途への今後の応用を考えると、さらなる安全性、エネルギー密度の向上が求められています。
そこで、当研究室では、電解液に不燃性であるイオン液体(溶融塩)を用いることを検討しています。イオン液体はカチオンとアニオンの組み合わせで様々な機能性を持たせることができますが、この研究では図1に示すような146℃に融点を持つ中低温イオン液体を用いています[1, 2]。
具体的な実験内容としては、正極、負極、電解液を作製し、それらを用いて電池を構築して、充放電試験を行っています。試験後は必要に応じて、正極材料の変化を観察するためにX線回折測定や電子顕微鏡観察を行っています。また、電解液である溶融塩の安全性を評価するための検討として示唆走査熱量分析(DSC)や熱重量測定(TG)も行っています。
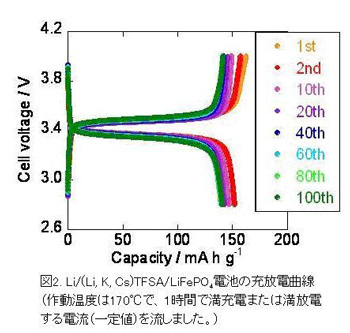
電解液の融点が146℃なので、電池の作動温度は170℃程度となりますが、温度が高い分、大電流を取り出しやすいなどのメリットもたくさんあることが分かってきています。図2に電池の充放電試験から得られた電池容量と電圧の関係を示しますが、1時間で充電を完了するような高速の充電を繰り返しても安定に作動しています[3]。
さらなる出力密度の向上など、まだまだ改善の余地はありますが、このような安全でエネルギー密度の高いリチウム二次電池が実用化されれば、今後普及が期待されている電気自動車のバッテリーとして、また、太陽光発電・風力発電などから得られた自然エネルギーの貯蔵用として有望です。現在問題とされているエネルギー・環境問題への対策として大きな役割を担うことが期待できます。
参考文献:
[1] K. Kubota, T. Nohira, T. Goto, R. Hagiwara, Journal of Chemical & Engineering Data, 53, 2144 (2008).
[2] A. Watarai, K. Kubota, M. Yamagata, T. Goto, T. Nohira, R. Hagiwara, K. Ui, N. Kumagai, Journal of Power Sources, 183, 724 (2008).
[3] 藤森徹也、後藤琢也、野平俊之、萩原理加、宇井幸一、熊谷直昭、電気化学会第76回大会要旨集、(2009).
フルオロハイドロジェネートイオン液体の合成と構造解析
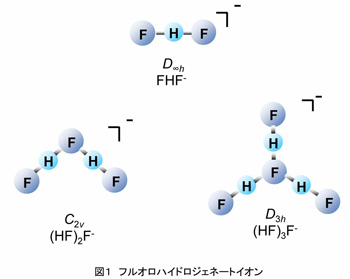
当研究室ではフルオロハイドロジェネートイオン液体の合成を行い、その基礎的物性を測定しています。フルオロハイドロジェネートイオン液体は図1に示すようなフルオロハイドロジェネートアニオンを含むイオン液体で、非常に高い導電率と低い粘性率を持つことが特徴です[1,2]。イオン液体の特徴はその組み合わせで様々な機能性を持たせることができるという点ですが、このアニオンは多くの種類のカチオンと低融点のイオン液体を形成し、幅広い分野での応用が期待されています。
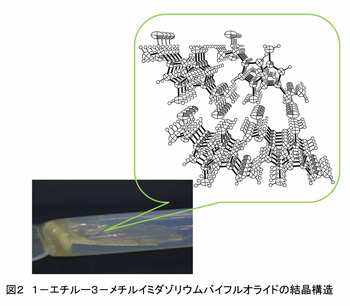
このように優れた特徴を持つフルオロハイドロジェネートイオン液体ですが、なぜこのように高い導電率を示すのかという点を解明するために、我々はX線回折、NMR分光、赤外分光、ラマン分光などの手法を用いてイオン液体の構造解析を行っています。X線回折法を用いると物質の結晶構造を決定することができます。図2に示すのは室温では固体(融点: 51℃)となる1-エチルー3-メチルイミダゾリウムバイフルオライドという化合物の結晶構造で、この物質は特徴的な層状構造を示します[3]。このような固体中でのイオン間相互作用がイオン液体中でどのように残っているか、あるいは変化しているかというのが興味深いところです。また、液体中でのイオンや分子の拡散係数を評価する方法に磁場勾配NMR法がありますが、この方法を用いることでフルオロハイドロジェネートイオン液体中ではアニオンだけでなくカチオンも早く移動できることがわかってきています[4]。
フルオロハイドロジェネートイオン液体の高い導電率を利用した電気化学デバイスへの応用は他のページで紹介しています(電気二重層キャパシタ、燃料電池)。
参考文献:
[1] R. Hagiwara, K. Matsumoto, Y. Nakamori, T. Tsuda, Y. Ito, H. Matsumoto, K. Momota, J. Electrochem. Soc., 150 (2003) D195.
[2] K. Matsumoto, R. Hagiwara, Y. Ito, Electrochem. Solid State Lett., 7 (2004) E41.
[3] K. Matsumoto, T. Tsuda, R. Hagiwara, Y. Ito, O. Tamada, Solid State Sci., 4 (2002) 23.
[4] Y. Saito, K. Hirai, K. Matsumoto, R. Hagiwara, Y. Minamizaki, J. Phys. Chem. B, 109 (2005) 2942.
新規フッ素系イオン液体の合成と性質
アニオンとカチオンのみから構成される液体で、難燃性、非常に低い蒸気圧、低融点などといった特長を示すイオン液体の中でも、当研究室では「フルオロハイ
ドロジェネートイオン液体」という、世界で最もイオン導電率の高いイオン液体を開発しており、このイオン液体を利用した燃料電池や電気二重層キャパシタと
いった電気化学デバイスへの応用を展開しています。
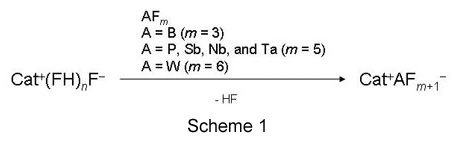
さて、フルオロハイドロジェネートイオン液体は、新しいイオン液体を純度よく合成する際の良い前駆体となります(Scheme
1)。我々はこの点に注目し、新規に様々なイオン液体を合成し、その融点やイオン導電率といった物理化学的性質に加えて、その結晶構造を明らかにすることを目的とした研究を行って
います。この合成法を用いると、ニオブ、タンタルやウランといった遷移金属をアニオンに含むイオン液体を合成することができます。また系統的に大きさの異なるフッ素系アニオンを用いたイオン液体の物性値を調べることでアニオンのサイズが物性に及ぼす影響などを調べています。
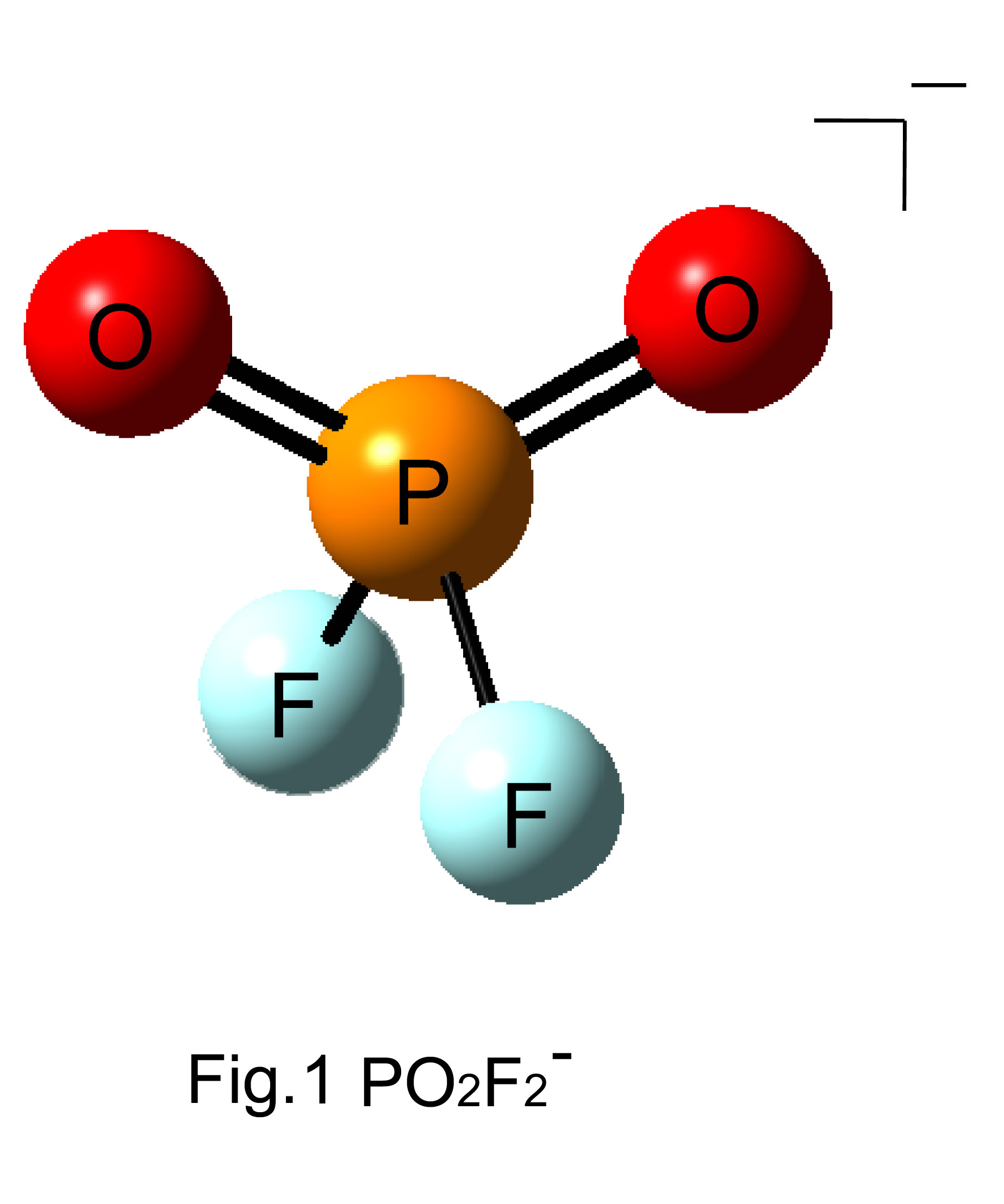
新規イオン液体としてBF4−とPF6−の中間のサイズをもつPO2F2−を対アニオンとしたものを合成し、このイオン液体が高い導電率と高い極性を持つことも報告しています。
参考文献:
[1] K. Matsumoto, R. Hagiwara, R. Yoshida, Y. Ito, Z. Mazej, P.
Benkic, B. Zemva, O. Tamada, H. Yoshino, S. Matsubara,Dalton Trans. 2004,
144-149.
[2] T. Kanatani, K. Matsumoto, R. Hagiwara, Eur. J. Inorg. Chem.
2010, 1049-1055.
[3] T. Kanatani, R. Ueno, K. Matsumoto, T. Nohira, R.
Hagiwara, J. Fluorine Chem., 130, (2009) 979-984.
[4] K. Matsumoto, R.
Hagiwara, Inorg. Chem. 48 (2009) 7350-7358.
新規イオン導電性中間相(柔粘性結晶と液晶)の開発と構造解析
液体と固体の間に見られる中間相は特異な性質を示すことから、様々な分野で研究対象となっています。代表的なものには柔粘性結晶(プラスチッククリスタル)と液晶(リキッドクリスタル)があり、その構造や物性には未知の部分が多くあります。柔粘性結晶中では構成分子が等方的に回転しており、球体のように振る舞うことから、膨張した格子中で単純な分子配列が見られます。一方で液晶では分子間の相互作用から、分子同士がある方向に配向しており、異方的な構造が見られます。我々は特に新規導電材料としての応用を目指して、イオン性の柔粘性結晶や液晶を合成し、その構造、導電性、電気化学的特性を調べています。これらの材料が実用化されればより安全で高効率な電池やキャパシタが実現されます。
参考文献:
[1] R. Taniki, K. Matsumoto, R. Hagiwara, K. Hachiya, T. Morinaga, T. Sato, J. Phys. Chem. B, 117 (2013) 955-960.
[2] F. Xu, K. Matsumoto, R. Hagiwara, J. Phys. Chem. B, 116 (2012) 10106-10112.
[3] F. Xu, K. Matsumoto, R. Hagiwara, Dalton Trans., 41 (2012) 3494–3502.
[4] F. Xu, K. Matsumoto, R. Hagiwara, Chem. Eur. J., 16 (2010) 12970-12976.
フッ素系化合物の結晶構造解析
物質の多くは結晶相を持ち、その結晶中で規則性を持って原子が配列しています。我々はこの結晶中での原子の配列をX線回折法や振動分光法を用いて調べています。特にフッ素はハロゲン中サイズが最も小さく、電気陰性度が大きいという特徴を持つことから特有の化学結合を持った化合物を多く形成するため、研究対象として興味深いことが知られています。我々は通常の実験施設では取り扱い難い不安定なフッ化物から、上述のようなイオン液体を低温で固めた固体など様々な物質の結晶構造を決定しています。下記には例としてリチウム電池用電解質として知られるLiBF4の結晶中におけるLi+周りの配位構造(左側)と新規アニオンであるAl2F93−の分子構造(右)を示します。その他の当研究室で決定された結晶構造はStructure
Archiveにあります。[1, 2, 3]


参考文献:
[1] K. Matsumoto, R. Hagiwara, Z. Mazej, E. Goreshnik, B. Zemva,
J. Phys. Chem. B 110 (2006) 2138.
[2] F. Xu, K. Matsumoto, R. Hagiwara, Dalton Trans. 42 (2013) 1965-1968.
[3] K. Matsumoto, T. Oka, T. Nohira, R. Hagiwara, Inorg. Chem., 52
(2013) 568-576.








